ISO 17025 akreditované laboratoře
Řešení pro akreditované laboratoře – zajištění systému akreditace anebo statistické vyhodnocování validací metod, nejistot a regulačních diagramů.
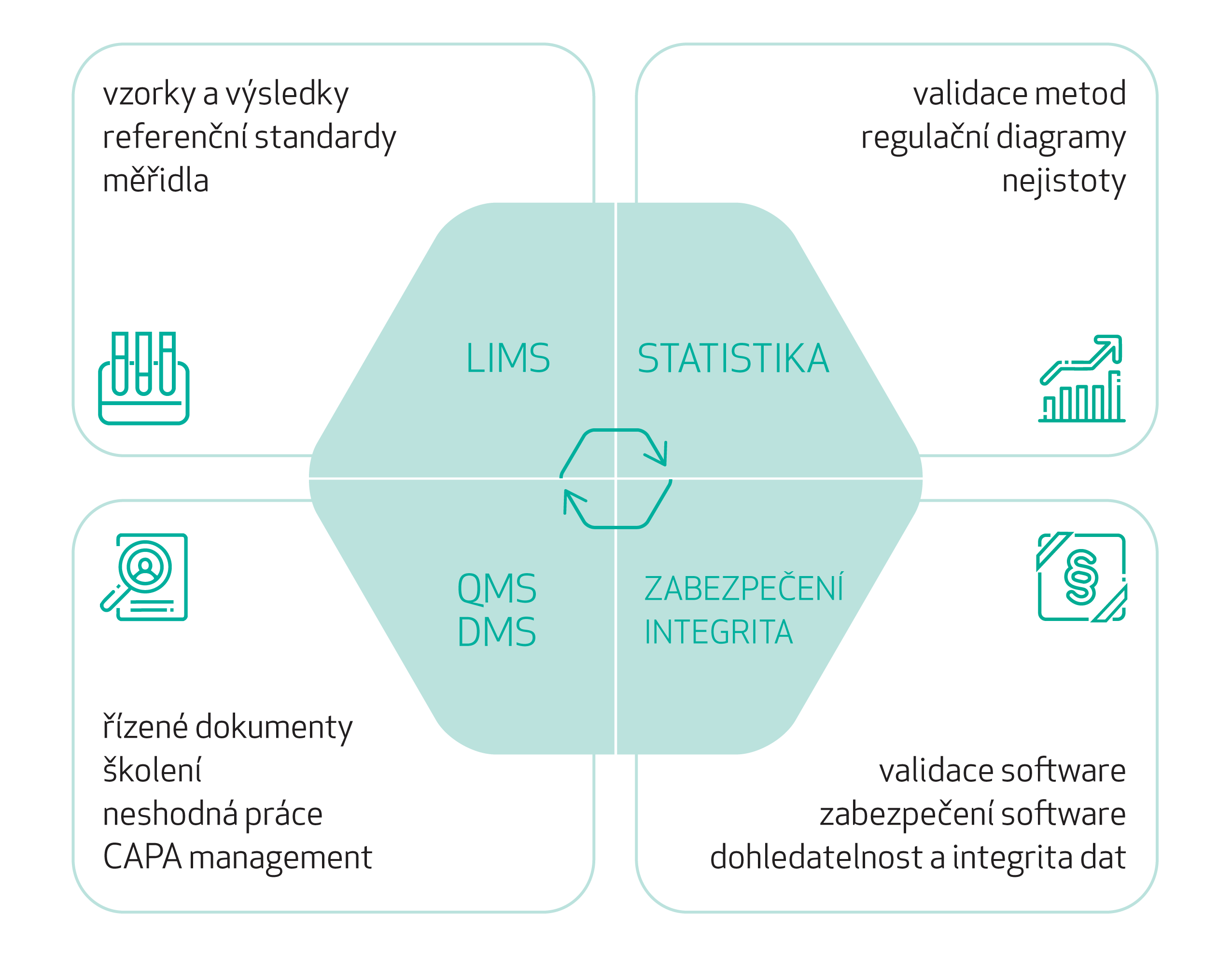
Charakteristiky a funkce
Software je vyvíjen ve shodě s požadavky SVP pro CZ/EU, USA (FDA) resp. celosvětově dle požadavků ICH, včetně požadavků VYR-32 SUKL resp. EudraLex – Volume 4 Good Manafacturing Practice, doplněk 11 (Annex 11), požadavků 21 CFR Part 11 a ve shodě s požadavky a metodikou GAMP 5 na validaci software.
LIMS je určen k řízení procesů v laboratoři a vedení souvisejících evidencí. Základní je zkoušení vzorků resp. šarží, zaznamenávání výsledků a porovnávání se specifikací. Tento proces se skládá z příjmu a evidence vzorku, testování a vložení výsledků, kontroly a schválení vzorku a reportování. Tomuto předchází tvorba specifikací a vývoj a validace metod zkoušení, které jsou přes LIMS také evidovány, řízeny a vyhodnocovány. Obdobné platí pro evidenci měřidel a management kalibrací, pro referenční materiály a jejich certifikace a sledování platnosti, pro evidenci chemikálií, roztoků, chromatografických kolon a pomocného materiálu.
LIMS dále dovoluje plánování, evidenci a vyhodnocování stabilitních studií a zaznamenání údajů z monitoringu prostředí a podpůrných systémů. Využívá také čárové kódy a QR kódy a podporuje manažerské reportování. Aktuálně vyvíjíme napojení LIMS na přístroje a ERP systémy (v přípravě).
Moduly QMS slouží k vedení evidencí a řízení jakosti kontrolní laboratoře resp. celé farmaceutické společnosti. To zahrnuje evidence a vyhodnocování odchylek, proces řízení změn, audity a nálezy, management nápravných a preventivních opatření (CAPA), šetření výsledků mimo specifikaci (OOS), řešení stížností a řízení rizik.
Pro všechny moduly lze nakonfigurovat workflow odpovídající procesům zákazníka, využít systém emailových notifikací a další funkcionality, včetně manažerského reportování.
Řízení dokumentace a školení je nedílnou součástí systému řízení jakosti. Zahrnuje kompletní proces od tvorby a evidence dokumentu, přes připomínkování, schvalování, aktivace resp. publikování, pravidelných revizí, archivace resp. rušení dokumentu. Na dokumentaci je navázán management školení, počínaje tvorbou testů, testových otázek a definicí správných odpovědí, umožňující zaznamenávání a vyhodnocování odpovědí uživatelů, hodnocení testů, re-testování, hlídání termínů a dokumentaci plnění resp. neplnění školení, a eskalaci při neplnění.
Pro řízenou dokumentaci a školení lze nakonfigurovat workflow odpovídající procesům zákazníka, využít systém centra zpráv a emailových notifikací a další funkcionality, včetně manažerského reportování.
Statistické vyhodnocení dat lze napojit na LIMS modul metody nebo používat samostatně. Zahrnuje vyhodnocování validací zkušebních metod a odhadování nejistot výsledků, vytváření a vedení regulačních diagramů, tvorbu a vyhodnocování kalibračních modulů a vyhodnocování mezilaboratorního porovnání.
V případě, že existuje více způsobů statistického vyhodnocení, tak jsou obsaženy všechny. Např. u vyhodnocení správnosti je to pomocí t-testu a regresně, u vyhodnocení linearity pomocí korelačního koeficientu, ANOVA nebo pomocí znaménkového testu. Výstupem statistického vyhodnocení jsou numerické výsledky a graf, resp. automaticky generovaný report.
Požadavky normy, které lze se software zajistit
| ISO 17025 | Požadavek | EffiChem software |
| 6.4 | Vybavení | |
| 6.4.13 | O zařízení, které může mít vliv na laboratorní činnosti, se musí udržovat záznamy | Modul Měřidla |
| 7.2. | Výběr, verifikace a validace metod | Modul Řízená dokumentace > Metody |
| 7.2.1.3 | Laboratoř musí zajistit, že používá nejnovější platné verze metody, ledaže by to nebylo vhodné nebo možné. | Modul Řízená dokumentace > Metody |
| 7.2.1.5 | Laboratoř musí před zavedením ověřit, zda je schopna dosahovat požadované výkonnosti. Záznamy o verifikaci se musí zaznamenávat. | Metody > validace metod |
| 7.2.2. | Validace metod | Metody > validace metod |
| 7.2.2.1 | Laboratoř musí validovat nestandardní metody, laboratorní metody vyvinuté laboratoří a standardní metody používané mimo rozsah nebo jinak upravené.
Poznámka 2: Pro validaci se může použít jedna z následujících technik nebo jejich kombinace: a) kalibrace nebo vyhodnocení vychýlení (bias) a preciznosti použitím referenčních standardů nebo referenčních materiálů b) systematické hodnocení faktorů ovlivňujících výsledek c) testování robustnosti metody prostřednictvím změny kontrolovaných parametrů, jako jsou teplota inkubátoru, dávkovaný objem d) porovnání výsledků dosažených dalšími validovanými metodami e) mezilaboratorní porovnání f) vyhodnocení nejistoty měření výsledků na základě pochopení teoretických principů metody a praktické zkušenosti z provádění odběru vzorků nebo zkušební metody |
Metody > validace metod
> Správnost a přesnost > Robustnost > Robustnost > Správnost > Mezilaboratorní porovnání > Nejistoty z parciálních nejistot a nejistoty z vyhodnocení přesnosti anebo regulačních diagramů |
| 7.2.2.2 | Když se provedou změny u validované metody, musí se stanovit vliv takových změn a když se zjistí, že mají vliv na původní validaci, musí se provést nová validace | Metody > validace metod – re-validace metody po změně, při zachování dat z původní validace (Historie) |
| 7.2.2.3 | Výkonnostní charakteristiky validovaných metod posuzovaných pro zamýšlené použití musí odpovídat potřebám zákazníků a být v souladu se stanovenými požadavky
Pozn: Výkonností charakteristiky mohou zahrnovat ale nejsou omezeny na rozsah měření, přesnost, nejistotu měření výsledků, mez detekce, mez stanovitelnosti, selektivitu metody, linearitu, opakovatelnost nebo reprodukovatelnost, robustnost proti vnějším vlivům nebo citlivost vůči interferencím z matrice vzorku nebo zkoušeného objektu a vychýlení (bias) |
Metody > validace metod
> Rozsah > Nejistoty > Přesnost > Mez detekce > Mez stanovitelnosti > Selektivita > Linearita > Robustnost > Správnost (bias) |
| 7.2.2.4 | Laboratoř musí uchovávat následující záznamy o validaci:
a) použitý postup validace b) specifikace požadavků c) stanovení výkonnostních charakteristik metody d) získané výsledky e) prohlášení o platnosti metody, podrobně popisující vhodnost pro předpokládané použití |
Metody > validace metod
Postup validace Kritéria přijatelnosti Použité algoritmy Výsledky validace Prohlášení a report |
| 7.5. | Technické záznamy | |
| 7.5.1 | Laboratoř musí zajistit, aby technické záznamy o každé laboratorní činnosti obsahovaly výsledky a uváděly dostatek informací pro usnadnění, pokud je to možné, identifikace faktorů ovlivňujících výsledek měření a s ním spojené nejistoty měření a umožnily opakování laboratorní činnosti za podmínek co nejbližších původním. Technické záznamy musí obsahovat datum a identitu pracovníků odpovědných za každou laboratorní činnost a kontrolu dat a výsledků. Původní pozorování, údaje a výpočty se musí zaznamenávat v okamžiku jejich pořízení a musí být možné je přiřadit k příslušnému úkolu. | Modul > Vzorky > Výsledky, primární záznamy |
| 7.5.2 | Laboratoř musí zajistit, aby změny technických záznamů byly zpětně sledovatelné vzhledem k předchozím verzím nebo k původním pozorováním. Musí se uchovávat jak původní, tak pozměněná data a soubory, včetně data změny, údaje o pozměněných aspektech a pracovnících odpovědných za změny. | Záznamy > Revizní změny (audit trail) a Historie |
| 7.6. | Vyhodnocení nejistoty měření | Metody > Nejistoty |
| 7.6.1. | Laboratoře musí identifikovat příspěvky k nejistotě měření. Při vyhodnocování nejistoty měření se za použití vhodných metod analýzy musí vzít v úvahu všechny příspěvky, které jsou významné, včetně těch, které vyplývají z odběru vzorku | Metody > Nejistoty > Parciální nejistoty |
| 7.6.3 | Laboratoř provádějící zkoušení musí vyhodnocovat nejistoty měření. Tam, kde zkušební metoda neumožňuje rigorózní vyhodnocení nejistoty měření, se musí provést odhad na základě pochopení teoretických principů metody nebo praktických zkušeností z provádění dané zkušební metody | Metody > Nejistoty > Parciální nejistoty nebo Z měření pro vyhodnocení přesnosti nebo Z regulačního diagramu |
| 7.7. | Zajišťování platnosti výsledků | Regulační diagramy |
| 7.7.1 | Laboratoř musí mít postup pro monitorování platnosti výsledků. Výsledná data se musí zaznamenávat tak, aby umožňovala zjišťování trendů a tam, kde to je použitelné, byly využívány statistické postupy a přezkoumání výsledků | Regulační diagramy |
| 7.8. | Uvádění výsledků | Modul Vzorky > Výsledky |
| 7.9 | Stížnosti | Modul Stížnosti |
| 7.10 | Neshodná práce | Modul Šetření výsledků mimo specifikaci (OOS) |
| 7.11 | Řízení dat a management informací | Validace software |
| 7.11.2 | Laboratorní systém (systémy) managementu informací, používaný pro sběr, zpracování, zaznamenávání, vytváření zpráv, ukládání nebo vyhledávání dat musí být laboratoří před zavedením validován na funkčnost, včetně řádného fungování rozhraní v rámci laboratorního systému (systémů) managementu informací | Validace software |
| 8. | Požadavky na systém managementu | Modul Řízené dokumenty |
| 8.2 | Dokumentace systému managementu | Modul Řízené dokumenty |
| 8.3 | Řízení dokumentů systému managementu | Modul Řízené dokumenty |
| 8.4 | Řízení záznamů | Modul Řízené dokumenty |
| 8.7 | Nápravná a preventivní opatření | Modul Nápravná a preventivní opatření CAPA |
| 8.8 | Interní audity | Modul Audity |
Projektová podpora zákazníka
Validované datové úložiště - VDU 1.0


EffiValidation 4.0 – jednoduché řešení



